- 品牌
- 司鼎;OriCell
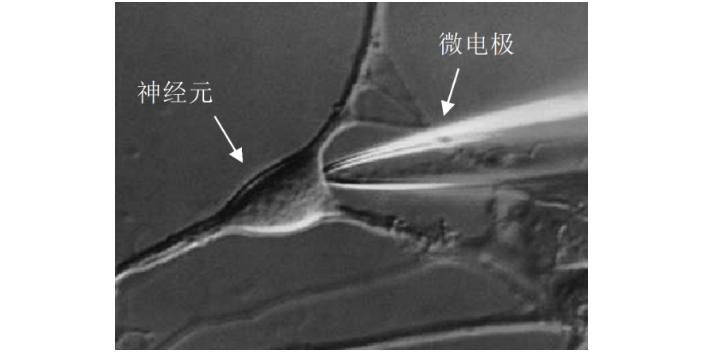
膜片钳操作实验:膜片钳实验难度大、技术要求高,要掌握有关技术和方法虽不是很困难的事,但要从一大批的实验数据中,经过处理和分析,得出有意义、有价值的结果和结论,就显得不那么容易,有许多需要注意和考虑的问题,包括减少噪音,避免电极前端的污染,提高封接成功率,具体实验过程中还需要考虑如何选取记录模式,为记录特定离子电流如何选择电极内、外液,如何选择阻断剂、激动剂,如何进行正确的数据采集等许多更为复杂的问题,还需在科研实践中不断地探索和解决。面对干细胞电信号研究,膜片钳技术可捕捉早期分化特征,帮助理解其功能成熟轨迹。杭州神经生物学膜片钳实验

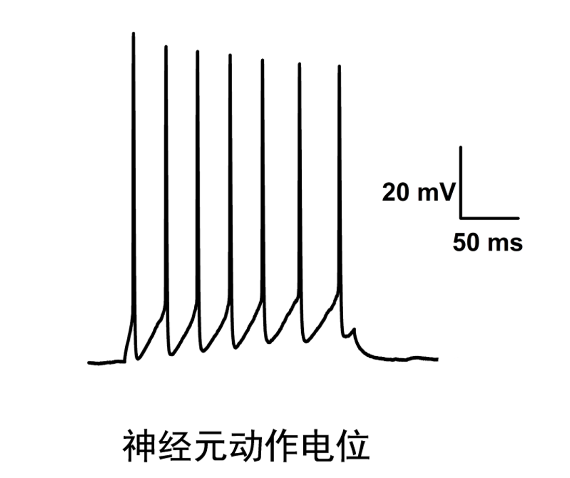
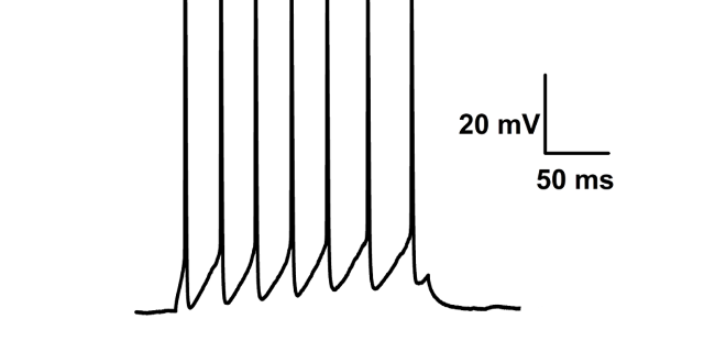
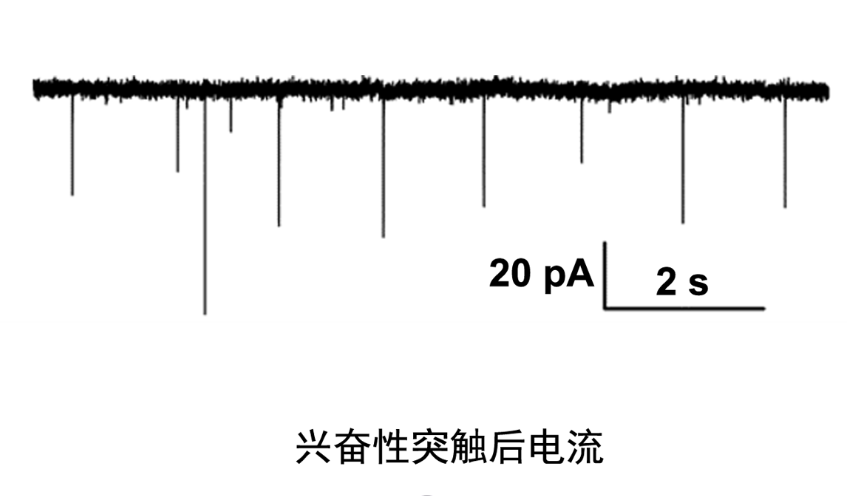
膜片钳在通道研究中的重要作用:利用膜片钳技术还可以用于药物在其靶受体上作用位点的分析。如神经元烟碱受体为配体门控性离子通道,膜片钳全细胞记录技术通过记录烟碱诱发电流,可直观地反映出神经元烟碱受体活动的全过程,包括受体与其激动剂和拮抗剂的亲和力,离子通道开放、关闭的动力学特征及受体的失敏等活动。使用膜片钳全细胞记录技术观察拮抗剂对烟碱受体激动剂量效曲线的影响,来确定其作用的动力学特征。然后根据分析拮抗剂对受体失敏的影响,拮抗剂的作用是否有电压依赖性、使用依赖性等特点,可从功能上区分拮抗剂在烟碱受体上的不同作用位点,即判断拮抗剂是作用在受体的激动剂识别位点,离子通道抑或是其它的变构位点上。杭州神经生物学膜片钳实验科研服务选品,膜片钳技术服务商推荐上海司鼎生物,专业度高。
膜片钳技术基本原理与特点:膜片钳技术本质上也属于电压钳范畴,两者的区别关键在于:①膜电位固定的方法不同;②电位固定的细胞膜面积不同,进而所研究的离子通道数目不同。电压钳技术主要是通过保持细胞跨膜电位不变,并迅速控制其数值,以观察在不同膜电位条件下膜电流情况。因此只能用来研究整个细胞膜或一大块细胞膜上所有离子通道活动。目前电压钳主要用于巨大细胞的全性能电流的研究,特别在分子克隆的卵母细胞表达电流的鉴定中发挥着其他技术不能替代的作用。
膜片钳电生理技术的基本原理:膜片钳技术用特制的玻璃微吸管吸附于细胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜只有少数离子通道。然后对该膜片实行电压钳位,测量单个离子通道开放产生的微小电流,这种通道的开放是一种随机过程。通过观测单个通道开放的电流幅值分布、开放概率、开放寿命分布等功能参数,并分析它们与膜电位、离子浓度等之间的关系。将该部分细胞采用负压吸破,可以形成较常见的全细胞记录模式,可以研究整个细胞的生理功能和离子通道电生理功能。更进一步,还可以把吸管吸附放膜片从细胞膜上分离出来,以膜的外侧向外或膜的内侧向外等方式进行实验研究。这种技术对膜内外溶液成分及施加药物操作都很方便。提升实验效率,自动化膜片钳技术能减少人工干预,适配批量样本研究。
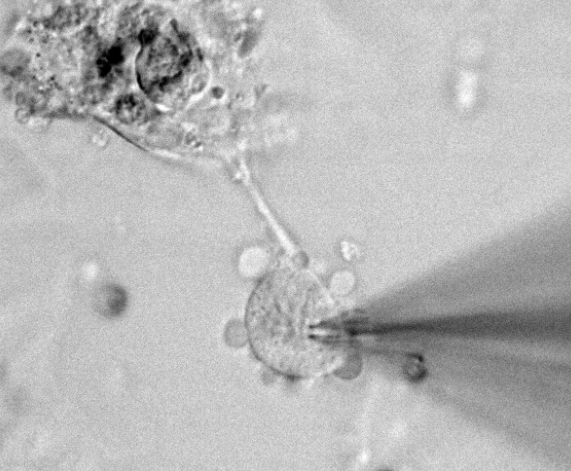
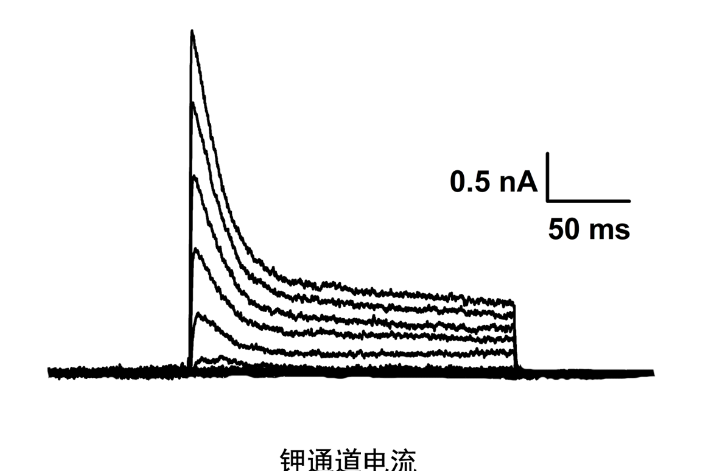
膜片钳在通道研究中的重要作用:应用膜片钳技术可以直接观察和分辨单离子通道电流及其开闭时程、区分离子通道的离子选择性、同时可发现新的离子通道及亚型,并能在记录单细胞电流和全细胞电流的基础上进一步计算出细胞膜上的通道数和开放概率,还可以用以研究某些胞内或胞外物质对离子通道开闭及通道电流的影响等。同时用于研究细胞信号的跨膜转导和细胞分泌机制。结合分子克隆和定点突变技术,膜片钳技术可用于离子通道分子结构与生物学功能关系的研究。全自动膜片钳系统技术指标:操作简单,全过程可自动化。苏州神经生物学膜片钳原理
膜片钳使用的注意事项:干燥季节请先用手触摸金属框架释放身体的静电。杭州神经生物学膜片钳实验
膜片钳技术—打开细胞电生理研究之门:膜片钳技术(patchclamptechniques)是采用钳制电压或电流的方法对生物膜上离子通道的电活动进行记录的微电极技术。膜片钳技术的原理:用一个尖锐端直径在1.5-3.0um的玻璃微电极接触细胞膜表面,通过负压吸引使电极尖锐端与细胞膜之间形成千兆欧姆以上的阻抗封接,此时电极尖锐端下的细胞膜小区域(膜片,patch)与其周围在电学上分隔,在此基础上固定(钳制,Clamp)电位,对此膜片上的离子通道的离子电流进行监测及记录。杭州神经生物学膜片钳实验
细胞膜片钳技术作为细胞生物学和电生理学的重要实验手段,依赖于高质量的设备和配套服务。选择合适的细胞膜片钳技术厂家,能够为科研工作提供稳定可靠的技术支持,确保实验数据的准确性和可重复性。该技术通过微玻管电极与细胞膜形成高阻抗封接,监测离子通道的电流变化,广泛应用于离子通道功能研究、药物筛选及疾病机制探索。专业的厂家不仅在设备制造上注重精密度和稳定性,还能提供完善的售后服务和技术培训,帮助用户解决实验中遇到的问题。上海司鼎生物科技有限公司作为一家立足于生命科学领域的科技企业,依托上海科研院所的技术优势,专注于膜片钳技术设备的研发和生产。公司不仅提供涵盖分子生物学、细胞生物学等领域的产品供应,还为用...
- 无锡细胞生物学膜片钳实验供应商 2026-03-10
- 温州细胞生物学脑片膜片钳原理 2026-03-08
- 常州神经生物学实用膜片钳方案 2026-03-07
- 嘉兴医学膜片钳技术研究方案 2026-03-06
- 芜湖细胞生物学离子通道技术 2026-03-05
- 无锡神经生物学离子通道原理及步骤 2026-03-04
- 南通细胞生物学电生理膜片钳技术 2026-03-02
- 常州全自动脑定位膜片钳原理 2026-03-02
- 苏州细胞生物学实用膜片钳原理及步骤 2026-03-01
- 莆田神经生物学膜片钳实验哪家好 2026-02-28
- 广州医学膜片钳成像方案 2026-02-24
- 芜湖医学膜片钳全细胞记录设计公司 2026-02-24
- 温州药理学膜片钳技术供应商 2026-02-13
- 金华医学实用膜片钳网站 2026-02-08
- 徐州全自动膜片钳全细胞记录应用 2026-02-05
- 芜湖细胞生物学电生理膜片钳研究方案 2026-02-05


- 芜湖细胞生物学离子通道技术 03-05
- 无锡神经生物学离子通道原理及步骤 03-04
- 南通细胞生物学电生理膜片钳技术 03-02
- 常州全自动脑定位膜片钳原理 03-02
- 苏州细胞生物学实用膜片钳原理及步骤 03-01
- 莆田神经生物学膜片钳实验哪家好 02-28
- 南京细胞生物学膜片钳全细胞记录设计公司 02-28
- 宁波药理学脑片膜片钳网站 02-27
- 宁波全自动离子通道应用 02-27
- 徐州药理学离子通道设计公司 02-25