- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
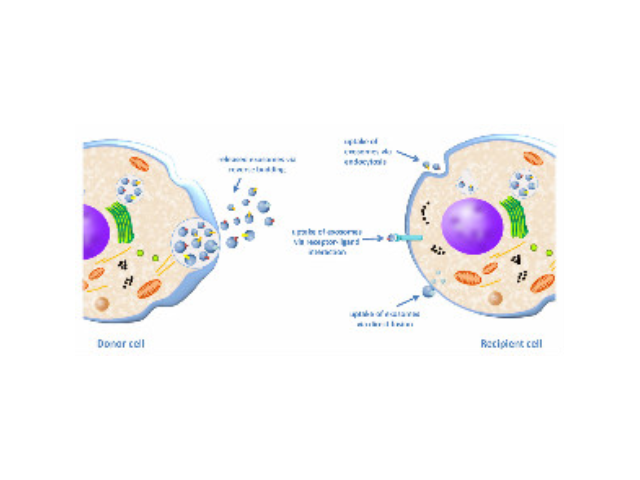
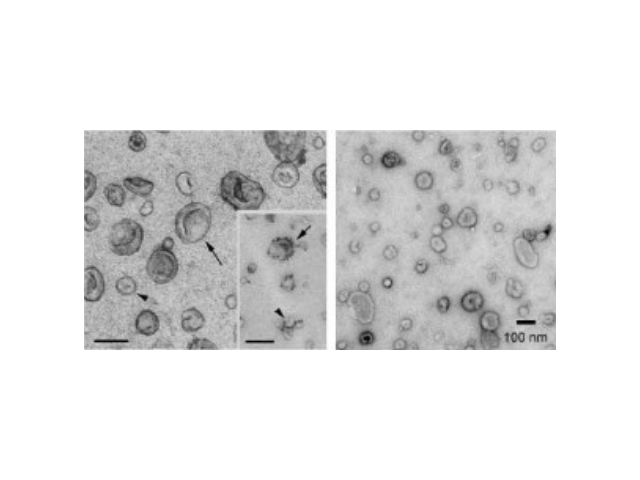
外泌体可通过流式、WB(检测指标有CD9,CD63,CD81)、电镜观察、NTA粒径追踪等手段检测,普遍应用于药物载体、疾病诊断marker、精细医疗、一些病症治病等方面研究。由于外泌体直径小,样本含量低,提取十分困难。已有的外泌体分离方式有密度梯度离心、超滤离心法、免疫磁珠抗体捕获、商用试剂盒等。但到目前为止,仍没有一种提取方法能同时保证外泌体的含量、纯度以及生物活性。外泌体是细胞间进行物质运输和信息交流的重要工具,可以通过调节免疫功能促进一些病症的增殖,血管新生和一些病症转移。与细菌传染,帮助细菌逃避免疫关系很大,并与心血管疾病,老年痴呆等疾病具有密切关系重复离心操作还有可能对囊泡造成损害,从而降低其质量。上海外泌体提取试剂供应商

研究表明被特定部位的细胞获取的一些病症外泌体可为一些病症的转移准备转移前微环境。用肺转倾向的一些病症细胞来源的外泌体处理小鼠后可使骨转倾向的一些病症细胞重新定向。外泌体的蛋白质组学分析发现不同部位倾向性的一些病症细胞来源的外泌体具有不同的整合素(integrin)表达谱,整合素α6β4和α6β1与肺转有关,而整合素αvβ5与肝转有关。敲低整合素α6β4和αvβ5可减少外泌体被靶部位细胞获取,进而分别降低了肺和肝的转移。进一步研究发现外泌体整合素被细胞获取后启动了Src的磷酸化和促炎的S100基因的表达。较后通过临床数据分析显示外泌体整合素可作为预测一些病症转移的部位倾向性的诊断指标。成都外泌体提取试剂销售厂家外泌体提取:用这种聚合物沉淀具有许多优点,包括对分离的外泌体影响小、pH中性等。

外泌体提取:尺寸排阻色谱。尺寸排阻色谱(Size-exclusionchromatography,SEC)是基于大小而非分子量实现分离大分子。该技术应用填充多孔聚合物微球的柱子,分子根据其直径通过微球,半径小的分子需要更长的时间才能通过色谱柱的孔隙迁移,而大分子则从色谱柱中更早地洗脱。尺寸排阻色谱可以精确分离大小分子。此外,可以将不同的洗脱溶液应用于该方法。与离心方法相比,色谱分离已被证明具有更多优势,因为通过色谱分离的外泌体不受剪切力的影响,这可能会改变囊泡的结构。目前,SEC是一种普遍接受的分离血液和尿液中外泌体的技术。不过,该方法耗时较长,不适合大量样本处理。
有的外泌体分离方法需要高速离心,需要使用大型机器,耗费近24小时的时间才能获得,非常不便。而高离心力也可能破坏囊泡。降低样品的质量。这项研究有望解决这一难题。在论文中,研究人员们提供了一种通过微流体和声学的独特组合从体液样品中捕获外泌体的新颖方法。他们开发的原始声学分选装置由两个倾斜的声学换能器和一个微流体通道组成,当这些传感器产生的声波相互碰撞时,形成产生一系列压力节点的驻波。每当细胞或颗粒流过通道并遇到一个节点时,压力会将细胞引导离开中心一点点。细胞移动的距离取决于大小和其他属性(如可压缩性),这样,当到达通道末尾时,不同大小和性质的细胞就能够被分离开来。这种方法分离得到的外泌体,基本上不改变其生物或物理特征,为开发评估人类健康以及疾病诊断和进展提供了有吸引力的新方法。用于外泌体提取的体液收集注意事项:操作要轻柔迅速。

外泌体的提取主要包括以下几种方式:一是超速离心法,这是目前外泌体提取较常用的方法。此种方法得到的外泌体量多,但是纯度不足,电镜鉴定时发现外泌体聚集成块,由于微泡和外泌体没有非常统一的鉴定标准,也有一些研究认为此种方法得到的是微泡不是外泌体。二是过滤离心,这种操作简单、省时,不影响外泌体的生物活性,但同样存在纯度不足的问题。三是密度梯度离心法,用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,量少。四是免疫磁珠法,这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备,但是非中性pH和非生理性盐浓度会影响外泌体生物活性,不便进行下一步的实验。五是PS亲和法,该方法将PS(磷脂酰丝氨酸)与磁珠结合,利用亲和原理捕获外泌体囊泡外的PS。该方法与免疫磁珠法相似,获得的外泌体形态完整,纯度较高。由于不使用变性剂,不影响外泌体的生物活性,外泌体可用于细胞共培养和体内注射。2016.9《ScientificReports》杂志发表了该方法较新数据,表明PS法可提取相当高纯度的外泌体。六是色谱法,这种方法分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。利用化合物沉淀将法外泌体沉淀出来。上海正规外泌体提取试剂单价
超滤离心法简单高效,且不影响外泌体的生物活性,但同样存在纯度不高的问题。上海外泌体提取试剂供应商
外泌体的提取、分离方法:梯度密度离心法。研究发现,外泌体的密度在1.1~1.19kg·L-1之间,因此,可以采用密度梯度离心法来分离外泌体。该方法是将超速离心结合蔗糖密度梯度或蔗糖垫结合,原理是先除去非囊泡物质,再通过梯度密度浓缩提取外泌体,该方法可以得到相对较为纯净的外泌体。传统的梯度密度方法通常需要离心16h,但是2012年,研究者[15]使用了62~90h才分离出某些确切囊泡,因此,该方法可能不足以沉淀所有的外泌体。如果离心时间不充足,污染物质可能和外泌体保持在相同的密度层,特别是这个密度范围又比较宽。上海外泌体提取试剂供应商
具体步骤是:以下所有步骤都在4℃下进行,1、300×g10min,弃沉淀,去除细胞2、2000×g20min,弃沉淀,去除死细胞3、10,000×g30min,弃沉淀,去除细胞碎片等亚细胞成分4、10,000×g70min,弃上清,沉淀即为外泌体5、PBS(每10ml细胞培养液用30mlPBS重悬)清洗沉淀物,混匀,10,000×g70min6、lmlPBS溶解沉淀(外泌体),立即使用或置于-80℃备用。7、一般超速离心法会结合密度梯度离心,这样得到的外泌体更纯,具体做法第4步后蔗糖梯度离心,10,000×g70min,以去除密度大于1.21g/ml的颗粒。优点是:成本低,操作简单,获得的囊泡...
- 芜湖外泌体提取试剂供应商 2024-11-14
- 长沙正规外泌体提取试剂哪家好 2024-11-14
- 长沙正规外泌体提取试剂供应商 2024-11-14
- 无锡正规外泌体提取试剂厂家供应 2024-11-14
- 贵阳正规外泌体提取试剂 2024-11-13
- 厦门外泌体提取试剂厂家现货 2024-11-13
- 无锡外泌体提取试剂厂家推荐 2024-11-13
- 昆明正规外泌体提取试剂平均价格 2024-11-13
- 济南外泌体提取试剂产品介绍 2024-11-13
- 开封正规外泌体提取试剂哪里买 2024-11-12
- 济南外泌体提取试剂单价 2024-11-11
- 开封外泌体提取试剂产品介绍 2024-11-11
- 宁波外泌体提取试剂厂家供应 2024-11-11
- 太原外泌体提取试剂产品介绍 2024-11-11
- 芜湖外泌体提取试剂进货价 2024-11-11
- 杭州外泌体提取试剂产品介绍 2024-11-11


- 正规鼠尾胶原厂家直销 11-17
- 深圳正规RNA提取试剂价格 11-17
- 苏州鼠尾胶原厂家现货 11-17
- 鼠尾胶原产品介绍 11-17
- 南昌RNA提取试剂进货价 11-17
- 厦门正规鼠尾胶原销售厂家 11-17
- 温州鼠尾胶原厂家推荐 11-17
- 天津RNA提取试剂单价 11-17
- 南京RNA提取试剂哪家好 11-17
- 深圳正规RNA提取试剂服务电话 11-17