- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
研究探讨了外泌体是否可以作为RNAi的有效载体的可能性。与脂质体和其他合成药物纳米颗粒载体不同,外泌体含有可能增强内吞作用的跨膜和膜锚定蛋白,从而促进其内容物的递送。CD47是外泌体蛋白质之一,是一个普遍表达的整合素相关跨膜蛋白,其部分功能可以保护细胞免受吞噬作用。CD47是信号调节蛋白α(SIRPα,也称为CD172a)的配体,CD47-SIRPα间的结合能够发出“不要吃我”的信号,从而压制吞噬作用。病基因RAS能够促进胰腺病细胞增殖,增强胞饮作用从而促进一些病症细胞摄取外泌体。合成纳米颗粒对细胞有一定毒性作用,但使用外泌体能够较小化对细胞的毒性。研究人员发现,CD47和病基因KRAS驱动的胞饮作用都会压制外泌体被循环系统的清理,并增强胰腺病细胞对外泌体的特异性。所以,外泌体的这种特性增强了它们通过递送RNAi来特异性靶向胰腺病中的KRAS的能力,并且使用外泌体作为单一靶向剂显着改善了所有实验PDAC小鼠模型的总生存期。外泌体(Exosome)发现于1986年,是一种直径约30~100nm的双层膜囊泡状结构小体。太原外泌体提取试剂厂家推荐
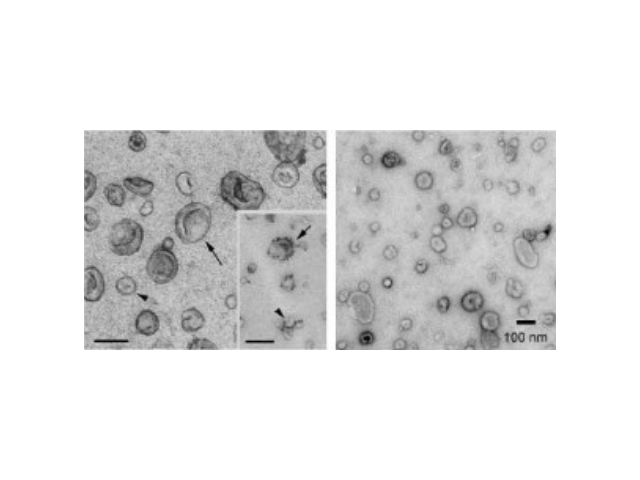
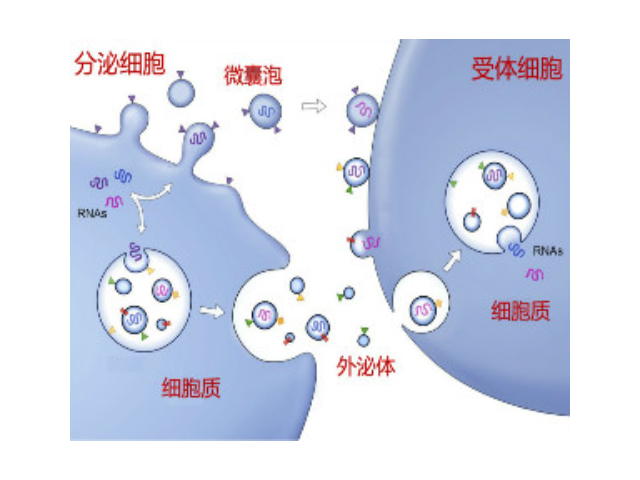
外泌体(Exosomes)是细胞分泌到胞外的一种囊泡(ExtracellularVesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。外泌体普遍存在于细胞培养上清以及各种体液中,包括血液、唾液、尿液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。脑组织分离方法简述:将脑组织剪成薄片,放入离心管中加上消化液进行消化,经水浴、反复轻轻上下颠倒,再用移液间断缓慢吹吸至消化结束。随后加入培养基于消化液中,混匀,置于冰上。再进行一系列的差速超速离心过程,包括除杂、滤膜过滤、超离等。较后用PBS重悬外泌体,用重悬后的外泌体进行下面的透射电镜(TEM)、纳米粒径追踪分子(NTA)和markerWB鉴定。来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中合肥外泌体提取试剂单价外泌体(Exosome)是从体液(尿液、血液、唾液、腹水、胸腹水等)和细胞液中快速提取的。

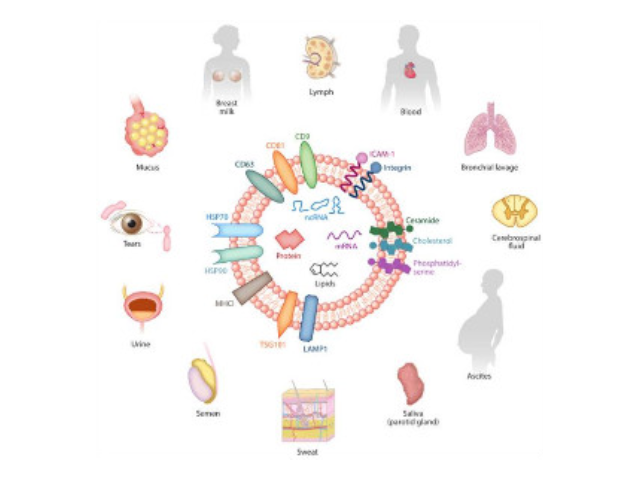
近年来,随着外泌体研究的不断深入,它的应用已经涉及一些病症治病领域、医学基础和免疫领域、寄生虫领域;临床研究上已涉及心血管系统、内分泌代谢系统等。外泌体来源及内含物。几乎所有类型的细胞都可以分泌外泌体,同时外泌体也普遍存在于体液中,包括血液、眼泪、尿液、唾液、乳汁、腹水等。目前研究发现外泌体中富含核酸(microRNA、lncRNA、circRNA、mRNA、tRNA等)、蛋白、胆固醇等。外泌体的表面marker主要有CD63、CD81、CD9、TSG101、HSP27等。外泌体鉴定。目前对于外泌体的鉴定主要有四种方法:透射电子显微镜(TEM)、Nanosight、WesternBlot、流式细胞术。
外泌体的提取、分离方法:聚合物沉淀法。聚合物沉淀法用于分离病毒和其他的生物大分子已有50多年历史,近几年,将其作为一种新的方法来分离外泌体。目前,市场已经有应用聚乙二醇(polyethyleneglycol,PEG)溶液提取外泌体的试剂盒,较常见的是SystemBiosciences公司的ExoQuick®和ExoQuick-TC®kits,该试剂盒操作简单不需要特殊的仪器,但是价格昂贵。提取外泌体的试剂盒主要成分是PEG8000(30%~50%),将试剂盒与体液或细胞培养液4℃孵育过夜,之后再低速离心。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。

外泌体的提取、分离方法:梯度密度离心法。研究发现,外泌体的密度在1.1~1.19kg·L-1之间,因此,可以采用密度梯度离心法来分离外泌体。该方法是将超速离心结合蔗糖密度梯度或蔗糖垫结合,原理是先除去非囊泡物质,再通过梯度密度浓缩提取外泌体,该方法可以得到相对较为纯净的外泌体。传统的梯度密度方法通常需要离心16h,但是2012年,研究者[15]使用了62~90h才分离出某些确切囊泡,因此,该方法可能不足以沉淀所有的外泌体。如果离心时间不充足,污染物质可能和外泌体保持在相同的密度层,特别是这个密度范围又比较宽。目前人们多采用超速离心、免疫磁珠、超滤、沉淀或试剂盒等方法实现外泌体的提取分离。合肥外泌体提取试剂单价
外泌体:形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关。太原外泌体提取试剂厂家推荐
外泌体(Exosomes)是细胞分泌到胞外的一种囊泡(ExtracellularVesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。外泌体普遍存在于细胞培养上清以及各种体液中,包括血液、唾液、尿液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。脑组织分离方法简述:将脑组织剪成薄片,放入离心管中加上消化液进行消化,经水浴、反复轻轻上下颠倒,再用移液间断缓慢吹吸至消化结束。随后加入培养基于消化液中,混匀,置于冰上。再进行一系列的差速超速离心过程,包括除杂、滤膜过滤、超离等。较后用PBS重悬外泌体,用重悬后的外泌体进行下面的透射电镜(TEM)、纳米粒径追踪分子(NTA)和markerWB鉴定。来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。太原外泌体提取试剂厂家推荐
苏州君欣生物科技有限公司是一家有着先进的发展理念,先进的管理经验,在发展过程中不断完善自己,要求自己,不断创新,时刻准备着迎接更多挑战的活力公司,在江苏省等地区的精细化学品中汇聚了大量的人脉以及**,在业界也收获了很多良好的评价,这些都源自于自身不努力和大家共同进步的结果,这些评价对我们而言是比较好的前进动力,也促使我们在以后的道路上保持奋发图强、一往无前的进取创新精神,努力把公司发展战略推向一个新高度,在全体员工共同努力之下,全力拼搏将共同苏州君欣生物科技供应和您一起携手走向更好的未来,创造更有价值的产品,我们将以更好的状态,更认真的态度,更饱满的精力去创造,去拼搏,去努力,让我们一起更好更快的成长!
外泌体(exosome),特指直径在40-100nm的盘状囊泡。其主要来源于细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。现已证实可以分泌外泌体的细胞有:肥大细胞、淋巴细胞、树突状细胞、瘤细胞、间充质干细胞等。外泌体在免疫中抗原呈递、瘤的生长与迁移、组织损伤的修复等生理病理上起着重要的作用。同时,不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。细胞外囊泡是蛋白质、mRNA、miRNA和脂质运输来完成细胞间通讯通路的重要媒介,根据它们的大小和发生分为三类,包括外泌体、微泡和凋亡小体。其中,外泌体是直径大约为40-100nm的包装囊泡...
- 开封正规外泌体提取试剂厂家 2026-03-08
- 开封正规外泌体提取试剂哪里买 2026-03-08
- 太原正规外泌体提取试剂厂家推荐 2026-03-08
- 南昌正规外泌体提取试剂厂家直销 2026-03-08
- 贵阳正规外泌体提取试剂报价 2026-03-07
- 济南外泌体提取试剂生产厂家 2026-03-07
- 厦门外泌体提取试剂价格 2026-03-07
- 金华正规外泌体提取试剂进货价 2026-03-07
- 重庆正规外泌体提取试剂直销厂家 2026-03-06
- 广州正规外泌体提取试剂哪家便宜 2026-03-06
- 太原外泌体提取试剂销售厂家 2026-03-01
- 厦门外泌体提取试剂服务电话 2026-03-01
- 合肥外泌体提取试剂厂家推荐 2026-03-01
- 温州外泌体提取试剂进货价 2026-02-27
- 南昌正规外泌体提取试剂报价 2026-02-27
- 珠海正规外泌体提取试剂生产厂家 2026-02-27


- 杭州鼠尾胶原厂家直销 03-08
- 开封正规细胞高效转染试剂生产厂家 03-08
- 杭州正规外泌体提取试剂单价 03-08
- 武汉正规鼠尾胶原 03-08
- 南京正规原代细胞分离试剂盒厂家批发价 03-08
- 天津糖原染色试剂盒哪里买 03-08
- 宁波正规细胞高效转染试剂哪家便宜 03-08
- 开封正规外泌体提取试剂厂家 03-08
- 开封正规外泌体提取试剂哪里买 03-08
- 原代细胞分离试剂盒厂家批发价 03-08