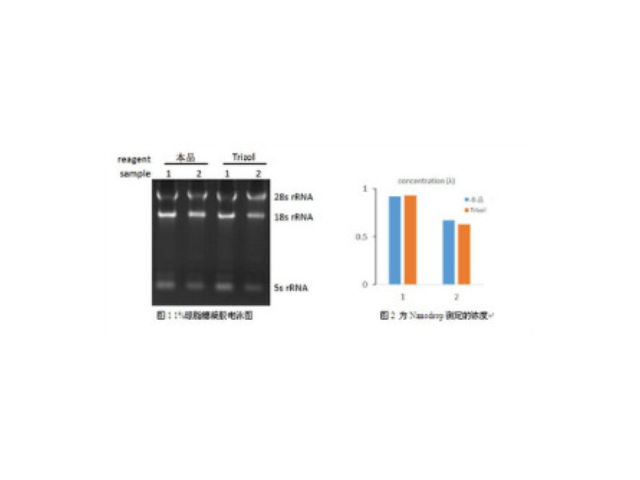
- 产地
- 苏州
- 品牌
- 鼠尾胶原
- 型号
- 齐全
- 是否定制
- 是
鼠尾胶原蛋白Ⅰ型使用方法及注意事项:将培养器皿在室温(25 度左右)下 放置 20 分钟待胶凝固后,转移到培养箱内。如果配制中使用的是 10PBS, 使用前需要加入适当体积的细胞培养液预平衡。 B.含细胞的三维胶原的制备(以配制 200ul鼠尾胶原蛋白(5mg/ml)加到(如果反过来把12ul 0.1mol/L NaOH 加到胶原溶液中,会由于 NaOH 不能迅速混匀而产生局部的胶原凝结),立即 混匀。再加入 23ul 10PBS 10培养液,混匀(混匀后pH 左右,如果 PBS 或培养液中没有加酚红,初次使用时需要用 pH 试纸测试)。加入 760ul 的细胞悬浮液,混匀后立即加到培养器皿中。将培养器皿在室温下放 20分钟待胶凝固后,加入适当体积的细胞培养液,转移到培养箱中培养。 注意事项 型在室温下pH 中性时可迅速成胶,在操作过程中要 尽量保持低温。鼠尾肌腱胶原蛋白I(rat tail tendon collagen type I)根据Birkedal-Hansen方法,经过醋酸(HAc)抽提、氯化钠沉淀、磷酸氢二钠沉淀等步骤制备所得。整个操作请于冰上进行,因室温下鼠尾胶原I可迅速成胶。上海南昌鼠尾胶原
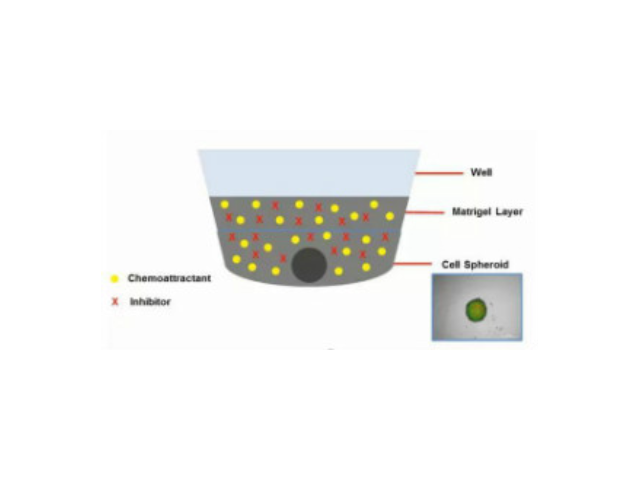
鼠尾胶原在心肌细胞氧化损伤中的保护作用:胶原蛋白具有抗氧化作用,但既往在实验室主要将鼠尾胶原用于促进细胞贴壁和支架构建,对于其抗氧化作用目前尚无相关研究。目的:探讨鼠尾胶原对过氧化氢导致离体心肌细胞氧化损伤的保护作用。方法:将原代培养的SD大鼠乳鼠心肌细胞随机接种到铺有鼠尾胶原的培养皿(实验组)和普通培养皿(对照组)中,并且均用0,10,100μmol/L H2O2诱导。24 h后,以电子显微镜观察各组乳鼠心肌细胞的形态,应用MTT比色法检测心肌细胞存活率,TUNEL法检测心肌细胞凋亡形态,流式细胞技术检测心肌细胞凋亡率,黄嘌呤氧化酶法检测超氧化物歧化酶活力,硫代巴比妥比色法检测丙二醛水平,Western-Blot检测凋亡蛋白Bax、Bcl-2的表达。结果与结论:两组培养皿中,随着过氧化氢浓度的增高,均可见细胞凋亡状态明显加重,细胞存活率及细胞内过氧化氢活力明显下降,细胞凋亡率及细胞内丙二醛水平明显增高,Bcl-2/Bax比值明显降低,呈剂量依赖性。宁波珠海鼠尾胶原前庭毛细胞贴附于培养皿底壁,易于封接和长时间(约8h)的观察和记录。

利用鼠尾Ⅰ型胶原构建与人类自体骨组织化学成分和分子结构相近的仿生骨材料。 方法 通过醋酸酸解提取鼠尾Ⅰ型胶原蛋白,并重构成胶原纤维。然后,将重构后的胶原纤维放置在矿化液中模仿骨生物矿化2~6 d,通过透射电子显微镜和电子衍射观察骨生物矿化。 结果 酸解提取的鼠尾Ⅰ型胶原蛋白能够重构成胶原纤维,并且具有特征性的D-Band结构。透射电子显微镜和电子衍射显示:矿化2 d后,羟基磷灰石钙前体渗入胶原纤维,胶原纤维部分矿化;矿化6 d后,胶原纤维内部完全矿化,形成Ⅰ型胶原蛋白/羟基磷灰石钙的仿生骨材料。 结论 利用酸解法提取的鼠尾Ⅰ型胶原蛋白可以重构成胶原纤维,经矿化可形成与人类自体骨组织化学成分和分子结构一致的仿生骨材料。
胶原蛋白是脊椎动物和无脊椎动物支持结构的主要组成。在人的身体中这是皮肤、筋、软骨、骨骼及结缔组织的较主要的蛋白质。胶原蛋白占人体蛋白质总量的三分之一, 不论来源于哪一种动物或哪一种组织的胶原都有许多共同特性。氨基酸组成中约有三分之一为甘氨酸,有脯氨酸和羟脯氨酸。根据其遗传分子结构遗传基因的差别,胶原蛋白分为20 几个亚型。但较为常见的为Ι、Π、ΙΙΙ型胶原蛋白,即间质胶原蛋白。其中I型较为丰富且品质优良。使胶原纤维在电子显微镜下形成间距为680埃的明暗相间的特征性的横纹结构。

鼠尾胶原蛋白Ⅰ型使用方法及注意事项:三维胶原的制备 鼠尾胶原蛋白 型在浓度1mg/ml 以上, pH 左右时可形成具有一定强度三维胶,建议成胶浓度 1-2mg/ml。胶原蛋白溶解于 0.006mol/L 乙酸 中,在成胶过程中需要加入 0.06体积的 0.1mol/L NaOH 来中和。 需要的溶液 (均需要无菌、 预冷) 10mg/L 酚红用于pH 指示) 0.1mol/LNaOH,0.1mol/L乙酸(一 般不用),双蒸水 200ul鼠尾胶原蛋白 型(5mg/ml)加到置于冰浴的离心管中,加入 690ul H2O 12ul0.1mol/L NaOH 12ul0.1mol/LNaOH 加到胶原溶液中, 会由于 NaOH 不能迅速混匀而产生局部的 胶原凝结) 立即混匀。再加入 100ul 10PBS 10培养液,混匀后立即加到培养器皿中(混匀后 pH 左右,如果PBS 或培养液中没有加 酚红,初次使用时需要用 pH 试纸测试)。将培养器皿在室温放置20min待胶凝固后,转移到培养箱内。上海南昌鼠尾胶原
鼠尾胶原蛋白 型在浓度1mg/ml 以上, pH 左右时可形成具有一定强度三维胶。上海南昌鼠尾胶原
鼠尾胶原的提取步骤:配置含4.5mmol/lNacl 和0.05mol/l Tris-base 的Tris-Hcl溶液(用盐酸将其PH值调至7.5) 取鼠尾,去皮,由尖部向前分段抽取肌腱,置于生理盐水中,称重,再倒掉生理盐水,酒精中浸泡20分钟 离心胶原溶液,(1200rpm10min) 取上清 每600上述粗提液加100ml0.14mol/l NaOH溶液离心,(8000rpm 5min) 其上清,留絮状沉 10.将絮状沉淀物置于三蒸水中,用0.1mol/l(1000:6) 醋酸溶解絮状沉淀物,加入消毒过的搅拌 子,冷房搅拌数天,得絮状胶原。 注意所有和胶原有关的操作都在冰上进行\ Rat tail collagen type 配置含4.5mmol/L NaCl 和0.05mol/l Tris-base 的Tris-HCl 溶液(用盐酸将其pH值调至7.5); 于-20冰箱中取出鼠尾,浸泡75%或70%酒精,解冻; 在一小培养皿中放置少量生理盐水,置于电子秤上,调零; 取鼠尾,去皮,由尖部向前分段抽取肌腱,置于生理盐水中。上海南昌鼠尾胶原
胶原的立体结构与一般的球状蛋白质完全不同,每一条亚基形成一股左手旋转的螺旋,其中每3个氨基酸残基形成一圈螺旋。3条左手螺旋再扭在一起形成一个右手大螺旋。这样的螺旋称为3股螺旋。小的甘氨酸残基位于3股螺旋内部。3股螺旋式的棒状胶原分子的大小约是3000×15埃,这些棒状分子首尾相连,并侧向排列形成胶原微丝(其直径可从50埃至数千埃)。胶原分子在两端及沿轴向每隔680埃的距离存在极性区,这些极性区能和重金属离子结合,使胶原纤维在电子显微镜下形成间距为680埃的明暗相间的特征性的横纹结构。论鼠尾胶原能促进毛细胞贴壁,涂布鼠尾胶原有利于膜片钳实验的长时程记录,并且制作简便,成本低廉。免疫组织化学结果和...
- 郑州正规鼠尾胶原产品介绍 2024-11-16
- 温州鼠尾胶原生产厂家 2024-11-16
- 芜湖成都鼠尾胶原 2024-11-15
- 无锡正规鼠尾胶原产品介绍 2024-11-15
- 珠海正规鼠尾胶原厂家 2024-11-15
- 徐州正规鼠尾胶原服务电话 2024-11-15
- 芜湖正规鼠尾胶原推荐厂家 2024-11-15
- 厦门正规鼠尾胶原价格 2024-11-15
- 温州鼠尾胶原报价 2024-11-15
- 成都鼠尾胶原厂家批发价 2024-11-15
- 天津正规鼠尾胶原单价 2024-11-14
- 贵阳正规鼠尾胶原直销厂家 2024-11-14
- 徐州珠海鼠尾胶原 2024-11-14
- 温州正规鼠尾胶原厂家直销 2024-11-14
- 徐州长沙鼠尾胶原 2024-11-14
- 重庆鼠尾胶原哪家好 2024-11-13


- 郑州正规鼠尾胶原产品介绍 11-16
- 温州鼠尾胶原生产厂家 11-16
- 苏州RNA提取试剂厂家推荐 11-15
- 太原RNA提取试剂直销厂家 11-15
- 宁波RNA提取试剂单价 11-15
- 芜湖成都鼠尾胶原 11-15
- 天津正规RNA提取试剂厂家现货 11-15
- 无锡正规鼠尾胶原产品介绍 11-15
- 厦门RNA提取试剂服务电话 11-15
- 珠海正规鼠尾胶原厂家 11-15